電位差測定装置の原理と応用
概要
電位差測定法は、溶液内の目的成分の濃度(活量)を作用電極と参照電極の起電力差から測定し、溶液中のイオン濃度や酸化還元電位の測定に利用されています。また、滴定と組み合わせて当量点の決定を電極電位変化より行う電位差滴定法もあり、電気化学測定法の一つとして古くから研究、応用されています。
本編では、電位差測定装置の原理を解説し、その応用装置であるpH 計、イオン濃度計、ORP(酸化還元電位)計の詳細と応用を紹介します。
1.電位差測定法について
電位差測定法(Potentiometry)は、溶液中の目的成分の濃度(活量)に応答する作用電極と参照電極との起電力差を電位差計で測定し、目的成分を分析する方法で、溶液中の各種イオン濃度(活量)や酸化還元電位(Oxidation Reduction Potential)の測定などに利用されている方法と、容量分析の当量点決定に電極電位の変化を利用する電位差滴定法があります。電気化学測定法の一つであり、1800 年代から研究され、応用されてきた測定方法です。
2.電位差測定装置
2.1 電位差測定装置の構成
図1 に示すように、2つの電極と電位差計で構成されます。
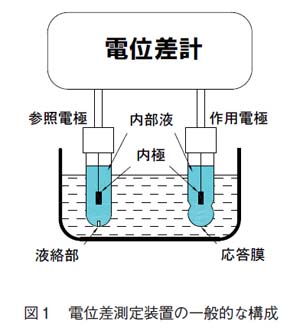
作用電極の応答膜で発生した電位を、参照電極と組み合わせて、電池を構成させ起電力差を電位差計で測定します。
![]()
2.2 参照電極
参照電極は、水素電極(電極電位0mV)が基準となりますが、水素を吹き付けることなどから、扱いが困難であり、水銀と塩化水銀を使用したカロメル電極(甘こう電極)や銀/塩化銀電極とよばれる参照電極が広く使用されています。近年ではカロメル電極は水銀を使うことから環境や人体への影響から使用されなくなり、現在ではほとんど銀/塩化銀電極が参照電極として使用されています。
銀/塩化銀参照電極の一般的なものは、ガラスやプラスチックのボディに内極、内部液、液絡部で構成されます。一般的な例として、銀/塩化銀内極、内部液3.3mol/L-KCl、液絡部多孔質セラミックが使用されます。
2.3 作用電極
作用電極は、特殊なガラスを感応膜とするガラス電極、単結晶や難溶性無機塩を感応膜とする固体膜電極、高分子膜を感応膜とする液体膜電極、白金などの金属を使用した金属電極などがあります。図2に例を示します。
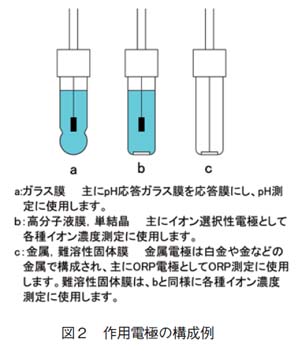
電位差測定装置で実用的に、使用されている代表的なものとしてpH 計、イオン濃度計、ORP計などがあります。
3.pH 計
pH は、水素イオン(オキソニウムイオン)活量を測定することから、イオン濃度計の一種となりますが、pH という指標が広く一般的に使用されているので、pH 計と独立した計測器として使用されています。電位差測定法を利用した最も代表的な計測器がpH 計になります。
pH は、水素イオン活量を示し、水溶液の酸性、アルカリ性の程度を示す指標で、式(A)で定義されます。
pH =-Log10[水素イオン活量]・・・(A)
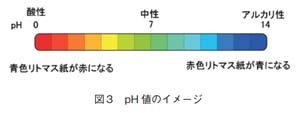
pH 7が中性で、7を中心に小さいものは酸性、大きいものはアルカリ性です。イメージとしてはすっぱいものが酸性、にがいものがアルカリ性で、人が口にしておいしいと感じるものは、ほとんど酸性のものです。
3.1 pH 測定原理極
pH 測定の標準は、ガラス電極法であり、水素イオン活量に応答する特殊なガラス膜で作られた作用電極(ガラス電極)と、pH に無関係に一定の電位を示す参照電極とから構成され、この2つの電極間に発生した電位差を電位差計(pH 計)で測定します。
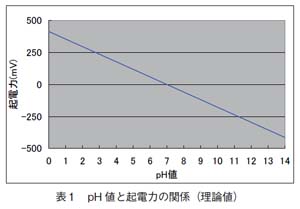
pH 測定で基本となるのがネルンストの式で、pH ガラス電極の起電力は、水温25℃では1pH当り59.16mV の電位差が発生します。pH ガラス電極の内部液がpH 7の場合、試料溶液のpHが7であれば、0mV の電位差(ガラス内部液と試料のpH が同じなので、電位差のない状態)、pH が8であれば- 59.16mV の電位差、pH が6であれば、+59.16mV の電位差を発生します。
3.2 pH 計の使用例
pH は、工場排水の規制や飲料水の基準など法律で測定が義務化されており、工場などからの排水は、現場設置型のpH 計により常時測定され、環境に影響しない状態(pH 値だけではありませんが)にして排出されています。又、食品や医薬品などにおいては、pH 値を管理しての品質維持や、微生物の発酵過程を測定することで、最適な発酵過程を導き出す等、さまざまな場面で使用されています。身近なところでは、熱帯魚の水槽のpH を測定しての水質管理などにも使用されていますが、一般生活では、pH 計で測定する場面はほとんど無く、pH 計で測定し数値管理されたものが、生活に入ってきているという重要な測定値です。
実際の装置は、図4 に示すように持ち運びが便利なポータブルpH 計、実験室などで使用されるラボ用pH 計、工場排水測定など使用される工業用pH 計と用途に合わせたものが使われています。

4.イオン濃度計
イオン濃度計の原理はpH 計と同じで、作用電極に各種イオンの活量に応答する感応膜を持った、イオン選択性電極を使用します。水素イオン濃度はpH という指標で表すのに対して、他のイオンは、mg/L やppm といった濃度単位で表します。
イオン選択性電極の種類は、陽イオンでは、ナトリウムイオン、カリウムイオン、カルシウムイオン、マグネシウムイオンなど。陰イオンでは、塩化物イオン、ふっ化物イオン、硝酸イオン、シアン化物イオンなど、それぞれのイオンに応答する感応膜が研究され、測定に使用されています。
血液中の電解質測定にナトリウムイオン、カリウムイオン、塩化物イオンなどのイオン選択性電極が使用されます。血液中の電解質は、個人差はありますが、ほぼ一定の範囲にあるので、これらイオンが増減することで、体液水分量の平衡状態の推測や、水代謝異常、酸・塩基平衡の状態を推測することができ、医療現場での診断にも役立っています。
環境に影響を及ぼすふっ化物イオンや、シアン化物イオンなどが、工業排水を監視するイオンモニターとして使用されていたり、ボイラー水の管理にナトリウムイオン電極が使用されていたりします。
5.ORP(酸化還元電位)計
ORP 計は、酸化還元電位を測定するものです。
酸化還元電位は、式(B)で表すことができます。
Eh=Eo+(2.303RT/nF)・log ([Ox] / [Red])・・・(B)
Eh:酸化還元電位
Eo:標準酸化還元電位
R:気体定数
T:絶対温度
F:ファラデー定数
Ox:酸化型の活量
Red:還元型の活量
Eh はOx が高くなれば高くなり、Red が高くなれば低くなることを意味しており、[Ox] /[Red]に左右されることから、酸化型、還元型の絶対量ではなく、比に依存していることもわかります。
ORP の値がプラスであれば酸化力が強く、マイナスであれば還元力が強いということになります。水での代表的な酸化体は酸素、還元体は水素で、これらの酸化還元電位は、水素が-420mV、酸素が+820mV です。
ORP は、その時の測定値を管理するよりもどのように変化しているかを確認する計測器として使用される場合が多い計測器です。
澤崎 毅
(東亜ディーケーケー(株))
2012年4月26日 公開












